Jaga
Bioanalüütiku erialas kui ka õppes on väga kiire areng toimunud ainuüksi viimase 15 aasta jooksul. Varasemalt ei olnud pooltki nendest tehnoloogilistest võimalustest nagu praegu. Analüsaatorite hulk õppelaborites on oluliselt kaasajastatud ja mitmekordistunud. Kõiki vahendeid on rohkem ja need on kaasaegsemad.
Kui 15 aastat tagasi esimesel kursusel mikroskoobi kasutamist õpiti pildil oleva mikroskoobiga, oli see hoopis teistmoodi kui nüüd. Mikroskoobil oli üks okulaar ja valgusallikat ehk lampi mikroskoobil üldse polnud, valgus tuli mikroskoobi küljes oleva peegli abil suunata kondensorisse, et preparaati valgustada. Peegliga tuli valgus püüda mõnelt valgusallikalt ja suunata kondensorisse ja sealt see koondus juba preparaadile. Seejärel sai tegeleda preparaadi pildi leidmise ja teravustamisega. Kogu tegevust hinnati ja see käis aja peale. Suurepärase hinde saamiseks pidid preparaadi pildi kätte saama ühe minuti jooksul. Tänasel päeval alustavad esmakursuslased kohe moodsate valgusmikroskoopidega ja ei pea peegliga valgust püüdma. Praegu kasutuses olevatel mikroskoopidel on kaks okulaari, mis teevad mikroskopeerimise olulisemalt lihtsamaks, sest ei pea ühte silma koguaeg kinni pigistama.
MIKROBIOLOOGIA
Arengud infektsioonide tekitajate kindlaksmääramisel lähtuvad mitmest oluliselt põhimõttest – esmalt peavad uuringud olema usaldusväärsed ja tõesed ning teiseks on vaja tulemused saada võimalikult kiiresti. Need on ka põhjused, miks aja jooksul on muutunud töös kasutatavad vahendid.

Bioanalüütikutel on nüüd võimalik kasutada mikroobide identifitseerimiseks ning ravimtundlikkuse määramiseks kiiresti tulemusi andvaid analüsaatoreid ning uuringute tegemiseks ühekordseid plastikust ja juba eelnevalt steriliseeritud vahendeid klaasist esemete asemel, mida oli vaja pesta, pakkida ja autoklaavida. Paljude infektsioonitekitajate kinnitamiseks kasutatakse nüüdisajal klassikaliste mikrobioloogia uuringumeetodite asemel nii tulemuse saamise kiiruse, ohutuse kui usaldusväärsuse tagamiseks pigem immunoloogilisi ja molekulaardiagnostilisi meetodeid ja seetõttu neid uuringuid mikrobioloogia osakondades ei tehtagi.
Siinkohal püüame anda pisikese ülevaate sellest, milliste vahenditega töötati mikrobioloogia laborites varasematel aegadel ja praegu.
Petri tassid
Põhilised töövahendid bakterite ja seente isoleerimiseks on siiani Petri tassid. Neisse valatakse sööde ehk mikroobide toit käsitsi. Tänapäeval tehakse seda pigem automaatsete söötmevalmistamise masinate ja dispenseritega. Need klaasist Petri tassid on praeguseks unustuse hõlma vajunud ja neid kasutatakse pigem lillepottide alusena. Nüüdisajal kasutatakse eranditult eelnevalt steriliseeritud ja ühekordseid Petri tasse.

Pipetid ja automaatpipetid
Kõiki klaasist vahendid tuli varem enne steriliseerimist autoklaavis pakkida kas jõupaberisse või mõnda teise tugevasse paberisse, mis auru toimel jäi terveks ja tagas enne lahtipakkimist vahendi steriilsuse. Autoklaavid ei olnud tänapäevaselt automaatselt või poolautomaatselt töötavad. Nende tööd juhiti käsitsi, autoklaavijal pidi olema tema pädevusi kinnitav tunnistus ja tema teadmiste hulka kuulus sellise hääle ära tundmine, mille järgi sai otsustada, et aurukambrist on õhk välja läinud. Seejärel pidi ta teadma, milline kraan tuleb kinni keerata ja milline lahti teha. Pidevalt pidi jälgima manomeetrite näite ja autoklaavimise protsessi lõpus ei tohtinud liiga vara autoklaavi ust avada – kogu autoklaavis olev kraam võis lennata vastu lage. Automaatsete ja poolautomaatsete autoklaavide protsessi ei pea masina kõrval jälgima ning ka ust ei ole võimalik enne aurukambri rõhu langust avada.
Mitmeid mõõtmistöid tehti klaasist pipettidega, mis olid üldjuhul mõõteskaalaga märgistatud. Enne steriliseerimisprotsessi pidid pipetid olema puhtad, kuivad, nende suupoolsesse otsa pandi käsitsi vatti, sest pipeteeriti ju suuga ja vatt „vältis“ uuritava materjali otse suhu sattumist näiteks veeproovide pipeteerimise korral. Pipetid pakiti, steriliseeriti autoklaavimisega või termostaadis. Tänapäeval on uuritava materjaliga kokku puutuvaks osaks vaid automaatpipettide ühekordsed steriilsed otsikud, mis peale kasutamist bioloogilise ohu konteinerisse ära visatakse. Automaatpipettide kasutamisel ei ole vaja suuga materjali pipetti tõmmata ja see teeb bioanalüütiku töö ohutumaks.
Pasteuri pipetid
Laialdaselt olid kasutusel klaasist Pasteuri pipetid, mida siis tuli ka eelnevalt pakkida ja steriliseerida. Need on küll väga hea terava otsaga, kuid tänapäevased eelnevalt steriliseeritud ja ühekaupa pakitud plastikust Pasteuri pipetid ei jää neile enam oma omadustelt alla ja võimaldavad kiiresti töötada, näiteks samastamisel kasutatavate API mikrokatsutite täimisel.

Külviaasad
Mikrobioloogialabori põhilised töövahendid on ka tänapäeval külviaasad, mida kasutatakse uuritava materjali inokuleerimisel. Need on ühekordsed ja kindla mahuga, enim on kasutusel külviaasad mahuga 1 µl või 10 µl. Aasa kindel suurus võimaldab teha kvantitatiivseid külve, kus uuritava materjali hulk on mõõdetud. Eriti oluline on see uriini uuringute korral, kus hinnatakse haigustekitajate hulka ja otsustatakse selle põhjal, kas on tegemist uroinfektsiooniga või pigem mitte.

Varem kasutuses olnud metallist külviaasasid steriliseeriti leegis kuni metall omandas hõõguvpunase värvuse, seejärel jahutati ning võeti uuritavat materjali. Peenemat sorti metallist külviaasade materjaliks oli plaatina, see kajastus ka nende külviaasade kõrges hinnas. See hind oli koguni nii krõbe, et ühes ettevõttes paigutati plaatinast külviaas nimetuse „loop“ all põhivahendite kategooriasse. Aasta lõpu inventuuri ajal ei leitud kuidagi „loopi“ ning inventeerijatele näidati ühte vana luupi. Kõik olid rahul ja inventuur edukalt läbitud.
Kaalud
Bioanalüütikud kasutavad oma töös palju kaalusid, sealhulgas dehüdreeritud söötmepulbrite kaalumiseks ehk mikroobidele toidu valmistamiseks. Ka söötmete valmistamise protsess on oluliselt muutunud. Kui varem kuulus söötmevalmistaja tööülesannete hulka turult ülimalt kvaliteetse liha hankimine ja sellest lihapuljongi keetmine, siis tänapäeval ostetakse purgike dehüdreeritud söötmepulbrit, milles on kõik uuritava mikroobi kasvu ja paljunemise jaoks olevad vajalikud ained õigetes proportsioonides olemas, lahustatakse see destilleeritud veega ja steriliseeritakse. Pulbri kaalumiseks läheb ikka kaalusid vaja, kuid kaalude käsitsemine on väga mugav, ei pea otsima õiget arvu vihtisid ühele kaalukausile ja tasakaaluasendit kahe kaalukausi vahel.

Durani pudelid
Söötmed pannakse steriliseerimiseks kolbidesse. Varem olid selleks kas koonilised või ümarkolvid või pudelid, mis kaeti kas käsitsi valmistatud vatikorgi või hiljem ka fooliumiga. Tänapäeval on mugavam ja ohutum ning steriilsuse säilitamiseks parem kasutada spetsiifilisi korgiga pudeleid (nimetatakse ka Durani pudeliteks) ehk siis varem kuulus mikrobioloogia laborandi tööülesannete hulka ka vatikorkide valmistamine.
Kui söötmed valmis, tehakse esmakülvid ja isoleeritakse haigustekitaja, mis on vaja identifitseerida ehk samastada ja lõpuks määrata isolaadi ravimtundlikkus.

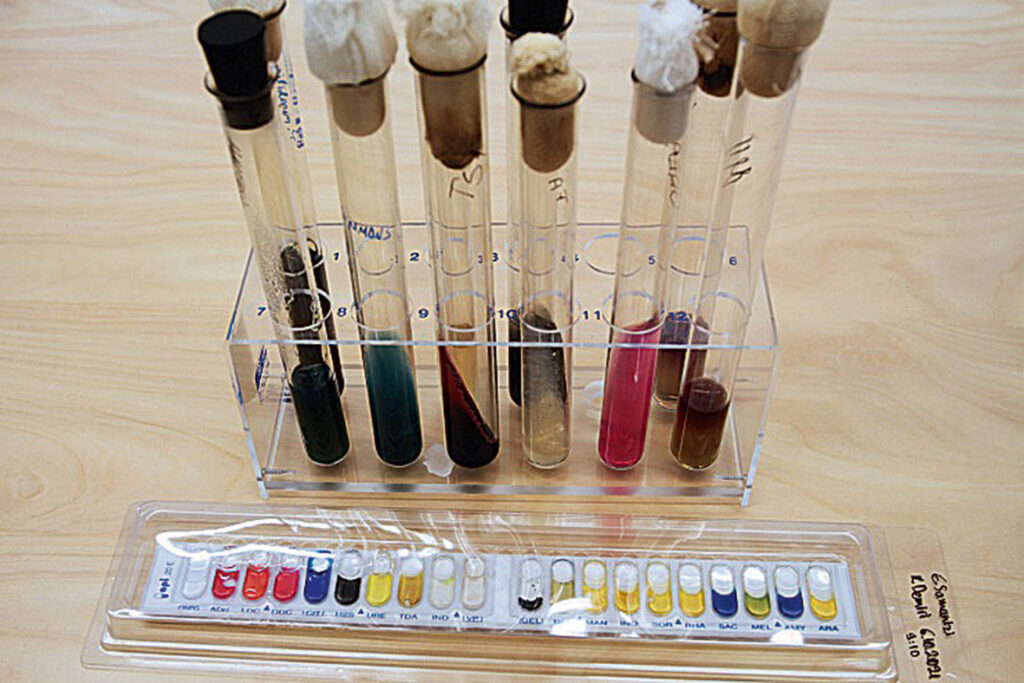
Mikroobide identifitseerimine biokeemilise rea ja API testi abil
Biokeemiline rida katsutites on mõnes väiksemas kliinilises laboris tagavarameetodina bakterite identifitseerimiseks kasutusel ka praegusajal, kuid pigem eelistatakse vähem materjali (söötmeid) ja ruumi võtvaid lahendusi ning kiiremini tulemusi andvaid meetodeid. Biokeemilise rea üks minivariantidest on API test, kus katsutite asemel toimuvad biokeemilised reaktsioonid mikrokatsutites. Mõlemal juhul on tegemist bakteri fenotüübiliste tunnuste kindlaksmääramisega ning nende tunnuste mustri põhjal uuritava bakteri identifitseerimisega. Paraku mõlemad meetodid on juba tasa-pisi ajaloo hämarusse vajumas, neid asendavad kiired ja võimsad analüsaatorid. Selliseid analüüse läbi viivaid seadmeid on erinevaid, enam levinud on ilmselt MALDI-TOF, mis määrab haigustekitaja valkude mustri, võrdleb seda andmebaasis olevaga ning annab selle põhjal mikroobi liigile nime. Ravimtundlikkuse määramine aga vajab ikka teatud kindla vanusega, standardsete mikroobirakkude olemasolu ka siis, kui selleks kasutatakse analüsaatori abi, disk-difusiooni või minimaalse inhibeeriva kontsentratsiooni määramise või mõnda muud praegusajal tunnustatud meetodit ja selle tõttu ei saa me veel bakterite kasvatamisest labori söötmetel loobuda.

Bioanalüütika kutsealana on jätkuvalt väga kiiresti arenev valdkond, see nõuab pidevat õppimist, uute teadmiste ja ka oskuste omandamist, teravat mõistust, erksust, tähelepanu, uueneva teabega pidevat kursis olemist ning järjepidevat materiaal-tehnilise baasi uuendamist. Bioanalüütikud ei saa lubada ajale jalgu jäämist kutseala ülikiiresti uueneva teabe valguses.
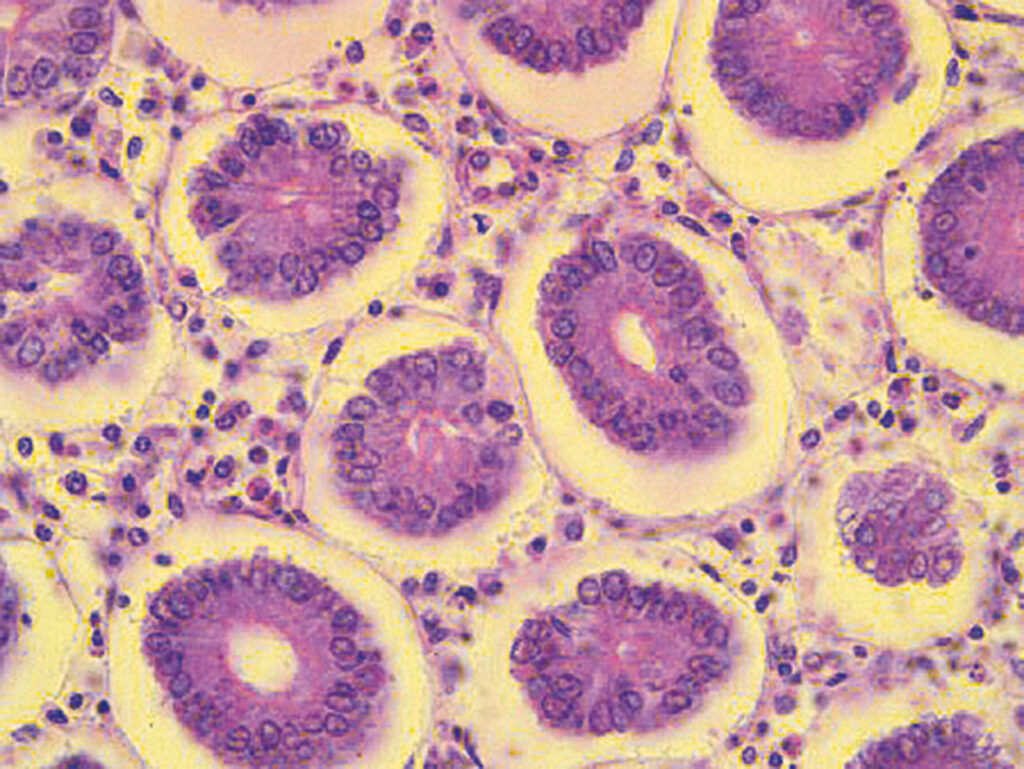
PATOLOOGIA
Patoloogialabor on üks laboritest, kus töötavad tänapäeval lisaks patoloogidele ka bioanalüütikud. Kui käsitleda patoloogia labori varustatust vahenditega, siis ausalt öeldes oli päris kaua reegliks, et patoloogia laboris on palju käsitsi nikerdamist. Mõnes mõttes kehtib see ka praegu, kuid siiski mitte sedavõrd kui paarkümmend aastat tagasi. Kui võrrelda tingimusi varasematus ja praegustes kliinilistes laborites, siis on suurte Eesti patoloogialaborite varustatus palju täienenud. Ja ka meie laboris on kasutusele võetud uusi aparaate ja kuigi kasutame praegu küll osalt sama nimega aparaate, kuid sisult on need kaasaegsed aparaadid. Nii on meil praegu olemas koeprotsessor, mis teeb ära preparaadi valmistamise protsessi materjali fikseerimisest üle veetustamise, intermeediumi ja parafiini viimise.
Sõltuvalt vajadusest võime koeprotsessori seada nii, et koe tükike oleks järgnevaks töötluseks valmis kas järgmisel hommikul või ka järgmise nädala esmaspäeva hommikul kella kaheksa kolmekümneks. Sama protsess võis võtta varasematel aastatel aega kas terve nädala või ka enam, sõltuvalt tundide sagedusest. Igas anumas pidid koetükid seisma, sõltuvalt kemikaalist millesse need pandi, poolest tunnist kuni kahe tunnini. Nii võttis kogu rea läbimine väga palju aega. Liiati oli kemikaale samuti palju: fiksaator, fiksaatorist vabastamine, veetustamine läbi alkoholi üleva rea (reas kolm, neli alkoholi), edasi intermeediumisse viimise rida, seejärel parafiini viimise rida (muidugi sulasse parafiini, seega toimus see termostaadis).

Kui koetükid tulevad sulast parafiinist, valatakse need vormidesse ja tahkestatakse. Ka seda teeme nüüd aparaadiga. Varem aga toimetasime termostaadi juures, mis oli seatud hoidma temperatuuri 58-59 °C. Kuna termostaat hakkas jahtuma niipea kui uksed avada, oli üsna palju selgitamist, kuidas tuleks töötada nii, et ka järgmisele üliõpilasele jääks termostaat endiselt samale temperatuurile: uks lahti, uks kinni, tõsta ümber järgmisesse parafiini, uks lahti, parafiin kappi, uks taas kinni. Ja nii tuli läbida kolm parafiini kokku ühe kuni kahe ööpäeva jooksul. Praegu teeb parafiinis hoidmise ära koeprotsessor ja valamisaparaadi juures vajutame aparaadi nupule ja sealt tuleb sula parafiin vormi, kuhu asetame ka koetüki, sellele kasseti ja paneme vormi koos koetüki ja kassetiga külmale lauale tahkuma, mõne aja pärast võtame tahke ploki vormist välja.


Järgneb lõikamine mikrotoomidega. Hetkel on meil neli uut mikrotoomi. Omal ajal oli vaid kaks, üsnagi ohtlikku mikrotoomi, millel tegelikult ei olnud mingeid ohutuse tagamise vahendeid. Aga kuna noad olid nii siis, kui on ka praegu äärmiselt teravad, on ohutuse tagamine väga oluline.
Ka nüüd töötame nii kelk- kui ka rotaatormikrotoomidega kuid praegusaegsetel mikrotoomidel on olemas nii noa katikud kui ka noa lukustussüsteemid, mis aitavad vältida endale sisse lõikamist. Paraku on aga paari mikromeetri paksusega lõigu kättesaamine ka tänapäeval esialgu päris keerukas. See on oskus, mida tuleb õppida ikka veel ja veel ning juhul kui ei lõigata päevast päeva, kipub see oskus ka tuhmuma.

Tõsi, ka meil on automaatne mikrotoom, aga isegi selle mikrotoomiga lõikamiseks tuleb eelnevalt teada, missugune kude missugust lõikamist vajab. Õppimise jooksul jõuavad üliõpilased selgeks õppida kogu koematerjali töötlemise põhiprotsessi, kuid automaatset mikrotoomi kõik üliõpilased proovida ei olegi saanud, sest lihtsalt aega ei jätku.
Küll aga saavad üliõpilased automaatset mikrotoomi kasutada lõputööde uuringute puhul. Ja kui üliõpilane on edukas, siis võib ta juba ka II kursuse aine raames proovida lõikamist automaatse mikrotoomiga.
Edasi toimetame samuti nagu varem käsitsi, ehk värvimisaparaati meil esialgu ei ole. Seetõttu värvime nii üldvärvinguid kui erivärvinguid käsitsi tõstes preparaate ühe värvi seest teise värvi sisse ja vahepeal preparaate ka loputades ning vajadusel neid protsessi jooksul mikroskoopidega uurides.

Lisaks vaatame valminud preparaate, hindame mis on õnnestunud ja millised on vead, õpime ka hindama preparaate, sest ka laborites kontrollitakse, milline on valminud preparaatide kvaliteet. Vaatamise käigus saame oma preparaate ka teistele näidata, sest mikroskoobid on ühendatud omavahel ja õppejõu mikroskoobiga süsteemi, milles on võimalik kõikides mikroskoopides olevaid pilte näidata nii õppejõule, kui ka ekraanile, kui ka seada enda ekraanipilt kõikide kaaslaste ekraanidele.
