Jaga
Biosensoritega puutusin esimest korda kokku üle kümne aasta tagasi, kui Tartu Ülikooli keemia instituudi tudengid soovisid abi, et kultiveerida spetsiifilisi baktereid, mille (terveid) rakke biosensorite valmistamisel kasutada saaks (Kibena jt 2013). Huvi selle teema vastu tekkis taas 2017. aastal, mil otsustasin astuda keemia instituuti doktoriõppesse, et seal just biosensoritega tegelema asuda. Et oma bioloogilist teaduspagasit kasutada, keskendusin bakterite – täpsemalt Escherichia coli (tavalise soolekepikese) – tuvastamisele biosensori abil. Suur oli lootus, et sellise põhjalikult uuritud mudelorganismi valik võiks tagada laialdased baasteadmised ja mõningase eelneva kogemuse. Hiljem muidugi selgus, et eeldused end paraku ei õigustanud – uurimistöö pigem püstitas uusi küsimusi kui aitas lahendada vanu (Jõgi jt 2020).
Vajalikud teadmised kolmes valdkonnas
Enne kui harutame lahti biosensori tööpõhimõtte, tuleb mainida, et tegemist on interdistsiplinaarse teadusega, mis on samal ajal selle ala tugevus kui ka nõrkus. Põhiliselt haarab biosensori arendus kolme teadusvaldkonda – bioloogiat, keemiat ja füüsikat. Hea saab olla töö tulemus siis, kui sinna õnnestub kaasata erinevate valdkondade spetsialiste, kuid tavaliselt kiputakse jääma „oma liistude juurde“ – publikatsioonide autorid on reeglina ikkagi ühe valdkonna esindajad. Eristada saab seega bioloogide, keemikute ja füüsikute biosensoreid. Vastavalt autoritele on alati kõige paremini lahendatud oma erialaga seotud probleemid.
Tavadefinitsiooni järgi on biosensor analüütiline seade, mis kombineerib bioloogilist komponenti ja füüsikalis-keemilist detektorit. Kui seda nüüd arusaadavamasse keelde tõlkida, on tegemist analüütilise mõõteseadmega, mis määrab mingi analüüdi (organismi, kemikaali jne) kontsentratsiooni või olemasolu.
Biosensori bioloogiline komponent on tavaliselt sensori võtmekomponent – see osa, mis tunneb ära spetsiifiliselt määratava ühendi. Sageli on see näiteks antikeha. Biosensori teine osa on detektor, mis töötab mingi füüsikalise või keemilise protsessi abil ning tekitab mõõdetava signaali vastavalt bioloogilise komponendi ja analüüsitava ühendi interaktsioonidele. Kõlab juba peaaegu arusaadavalt…
Ajaloolises plaanis pole biosensor mingi eriti uudne leiutis – biosensorite avastajaks peetakse Leland C. Clark jr-i, kes leiutas hapnikuanduri 1956. aastal. Esimene kommertsiaalne biosensor vere glükoosi taseme mõõtmiseks pärineb 1975. aastast (Naresh ja Lee 2021). Vaatamata pikale ajaloole on biosensorid jäänud laiema tähelepanuta ning pigem rakendusliku valdkonna alla liigituvaks teadusharuks.
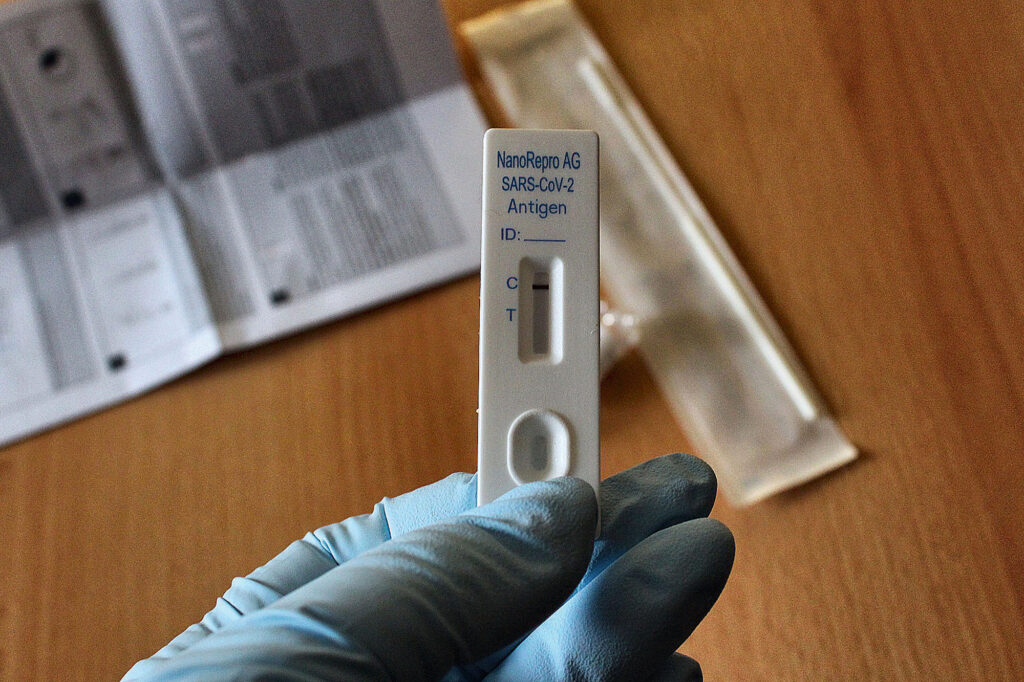
Kui üritaks nüüd õige biosensori tööpõhimõtet kirjeldada? Biosensori bioloogiline komponent tagab spetsiifilisuse, et me mõõdaks ikka õiget molekuli või organismi. “Keemia keeles” peaks mõõdetava analüüdi ja bioloogilise komponendi omavahelise tugeva (ehk spetsiifilise) keemilise reaktsiooni ehk seostumise dissotsiatsioonikonstandi Kd väärtus olema alla 10-7. Lihtsustatuna tähendab see seda, et kui uuritavas proovis leidub ka üksikuid biosensori mõõdetavaid molekule, siis enam need selle bio-äratundmiskomponendi küljest lahti ei tule. Või noh, teaduslikkuse huvides – lahti võib tulla üks molekul kümnest miljonist… Sellise spetsiifilise reaktsiooni tekitamisel on erinevaid mehhanisme, kuid tavaliselt kasutatakse kas mõõdetavale analüüdile spetsiifilist ensüümi (näiteks glükoosi oksüdaasi vere glükoositaseme hindamisel) või antikeha (bakterite, viiruste või keemiliste ühendite tuvastamisel).
Üldpilt on justkui arusaadav, kuid kui detailidesse laskuda, siis muutuvad asjad ruttu väga keeruliseks. Kui kasutada ensüümi, tekivad näiteks sellised küsimused: kas seda ensüümi suudetakse immobiliseerida (kinnitada biosensorile või kuskile maatriksisse – mingi analüüti läbilaskva kihi sisse „peita“), kui pikk on selle ensüümi eluiga sensoris jne. Antikehadega pole lood palju paremad, nimelt jaotuvad kasutatavad antikehad kaheks – polüklonaalsed antikehad ja mono – klonaalsed antikehad. Viimased neist on sellised, mis tunnevad uuritaval molekulil ära alati ühe konkreetse piirkonna. Polüklonaalsed antikehad tuvastavad seevastu uuritava molekuli mitmeid eri piirkondi, tegemist on sisuliselt erinevate antikehade seguga. Ideaaljuhul tuleks kasutada monoklonaalseid antikehi – paraku seab siin nende kõrge hind piirid ette. Enamasti kasutatakse polüklonaalseid antikehi, mille hind on palju odavam ning signaal tugevam kui monoklonaalsetel antikehadel. Spetsiifilisus ehk see, kas tuntakse ära õige molekul või organism, võib see-eest madalam olla.
Odavamaid ja väiksemaid analooge antikehadele on otsitud kaua – 1990. aastal leiutati sellised molekulid nagu aptameerid (Ellington ja Szostak 1990). Aptameerid on valdavalt lühikestest nukleotiidsetest järjestustest (20-80 aluspaari) koosnevad molekulid, mis sarnaselt antikehadele tunnevad erinevaid molekule spetsiifiliselt ära. Kui antikehade tootmine vajab elusorganisme või vähemalt elusrakkude kasvatamist, siis aptameeride selektsioon ja tootmine on oluliselt lihtsam ja odavam. Paraku kipuvad aptameerid antikehadele oma headuses ehk spetsiifilisuses alla jääma. Sel aastal ilmunud artiklis (Matsunaga jt 2021) aga kirjeldati uuel moel muudetud nukleotiide – nii-öelda viiendat ja kuuendat nukleotiidi (lisaks teadaolevale neljale), mis võimaldasid biosensori spetsiifilisust nihutada antikehadega samale tasemele.
Biosensori detektorosa võib varieeruda alates suhteliselt lihtsast kiirtesti keemilisest värvusreaktsioonist, mis analüüdi äratundmisel bioloogilise komponendiga tekib, kuni keeruka impedantsi mõõtmisel baseeruva detektorini. Põhimõtteliselt on impedantsi puhul tegemist sellise elektrokeemilise terminiga nagu näivtakistus ehk kui uuritaval analüüdil tekib vastastikmõju detektorile seotud antikehaga, siis mõõdetakse elektrilise takistuse (mahtuvuse) muutust. Nende kahe detekteerimispõhimõtte vahele mahub väga palju erinevaid detektoritüüpe. Mitmed, näiteks nanoosakestel baseeruvad biosensorid suudavad töötada ka tavapärase bioloogilise komponendita.
Kõik biosensorid ei ole kiirtestid
Tihti kiputakse biosensoreid segi ajama kiirtestidega – enamik kiirteste töötab küll biosensori põhimõttel, kuid kindlasti pole kõik biosensorid kiirtestid. Kiirtesti kompaktne suurus ja lihtne käsitsetavus loovad kasutajale petliku tunde, et tegemist on lihtsa analüüsiseadmega. Meetodi loogika võib paraku tihti äraspidine olla – kui mingit analüüsi on lihtne läbi viia, siis analüüsi tegelik tööpõhimõte on lausa peadmurdev; keerulise käiguga analüüsid võivad aga olemuselt üsna lihtsaks osutuda. Kiirtesti puhul on reaktsioonide läbiviimiseks vajalikud komponendid tavaliselt seotud nitrotselluloosiribale ning erinevad reaktsioonid hakkavad toimuma siis, kui sellele proovilahust peale kanda.
Nüüd proovingi kirjeldada ühe suhteliselt lihtsa, A- ja B-grippi tuvastava kiirtesti (Zhang jt 2019) põhimõtet. Nitrotselluloosiribale kantakse („trükitakse“) kolme erinevat antikeha – hiires toodetud A- ja B-gripi antikehad ning kontrolliks kitse hiirevastased antikehad. HRP-ga (horse radish peroxidase, maakeeli mädarõika peroksüdaas – lagundab H2O2) konjugeeritud hiirevastaste antikehadega immutatud konjugaadipadjake asetub enne peale kantud antikehasid. Proovi “pealekandmispadjake” immutatakse „ilmutuskemikaalide“ uureaperoksiidi, dekstraansulfaadi, 3,3´, 5,5´-tetrametüülbensidiini (TMB) ja tsitraatpuhvriga.
Mis juhtub, kui proovi kiirtestile pipeteerida? Proov imbub proovipadjakesse ja liigub kapillaarjõudude toimel piki nitrotselluloosriba koos seal asuvate kemikaalidega edasi. Kui proov jõuab konjugaadipadjakeseni, lisandub reaktsioonisegusse hiirevastaste antikehadega konjugeeritud HRP. Järgmisena jõuab kogu reaktsioonisegu (koos viirusosakestega) viirusspetsiifiliste antikehadeni. Pärast viirusosakeste kinnitumist spetsiifilistele antikehadele algab võimendav keemiline reaktsioon – HRP-ga konjugeeritud hiirevastased antikehad tunnevad ära antikeha-viirus kompleksi, peroksüdaas hakkab oksüdeerima 3,3´, 5,5`-tetrametüülbensidiini (TMB) ning moodustub värviline lahustumatu produkt, mis tegelikult markeerib ja võimendab keemiliselt biosensori antikeha ja viirusosakese interaktsiooni (tekib värviline triip, mis tähistab positiivset või kontrollreaktsiooni).
Kui nüüd toimuvaid keemilisi reaktsioone kokku lugema hakata, siis kiirtesti positiivse tulemuse tekkeks on vaja kolme erinevat reaktsiooni: viiruse antigeeni-antikeha ning viiruse antikeha ja hiirevastase konjugeeritud antikeha vahelist reaktsiooni; kolmandat reaktsiooni põhjustab konjugeeritud antikeha küljes olev peroksüdaas, oksüdeerimise tagajärjel tekib värvusreaktsioon. Viimase reaktsiooni võimendav efekt seisneb selles, et kui antikehade vahelised reaktsioonid toimuvad reeglina vahekorras 1:1-le, siis üks peroksüdaas suudab lagundada suhteliselt suure hulga peroksiidimolekule, mistõttu oksüdeeritakse suur hulk TMB-molekule ning mis tähendab, et kiirtest pruugib ka väheste viirusosakeste puhul anda positiivse tulemuse.
Kokkuvõtteks võib öelda, et lihtsa nimetuse „biosensor“ taga peidab end suur hulk väga erineva keerukuse ja analüüsivõimekusega seadmeid alates kiirtestist (mis ei ole sugugi nii lihtne kui paistab) kuni tehniliselt komplitseeritud analüüsiseadmeteni.
Viited
Ellington, Andrew D, and Jack W Szostak. 1990. “In Vitro Selection of RNA Molecules That Bind Specific Ligands.” Nature 346 (6287): 818–22. https://doi.org/10.1038/346818a0.
Jõgi, Eerik, Ingrid Väling, and Toonika Rinken. 2020. “Assessment of Bathing Water Quality with an E. Coli Immunosensor.” International Journal of Environmental Analytical Chemistry. https:// doi.org/10.1080/03067319.2020.1786549.
Kibena, Elo, Merlin Raud, Eerik Jõgi, and Timo Kikas. 2013. “Semi-Specific Microbacterium Phyllosphaerae-Based Microbial Sensor for Biochemical Oxygen Demand Measurements in Dairy Wastewater.” Environmental Science and Pollution Research International 20 (4): 2492–98. https://doi.org/10.1007/s11356-012-1166-8.
Matsunaga, Ken-ichiro, Michiko Kimoto, Vanessa Weixun Lim, Hui Pen Tan, Yu Qian Wong, William Sun, Shawn Vasoo, Yee Sin Leo, and Ichiro Hirao. 2021. “High-Affinity Five/Six-Letter DNA Aptamers with Superior Specificity Enabling the Detection of Dengue NS1 Protein Variants beyond the Serotype Identification.” Nucleic Acids Research, June. https://doi.org/10.1093/nar/gkab515.
Naresh, Varnakavi., and Nohyun Lee. 2021. “A Review on Biosensors and Recent Development of Nanostructured Materials-Enabled Biosensors.” Sensors . https://doi.org/10.3390/s21041109.
Zhang, Jing, Xun Gui, Qingbing Zheng, Yixin Chen, Shengxiang Ge, Jun Zhang, and Ningshao Xia. 2019. “An HRP-Labeled Lateral Flow Immunoassay for Rapid Simultaneous Detection and Differentiation of Influenza A and B Viruses.” Journal of Medical Virology 91 (3): 503–7. https://doi.org/https://doi.org/10.1002/jmv.25322.
